CELLE A COMBUSTIBILE – LA FONTE DI ENERGIA SOSTENIBILE
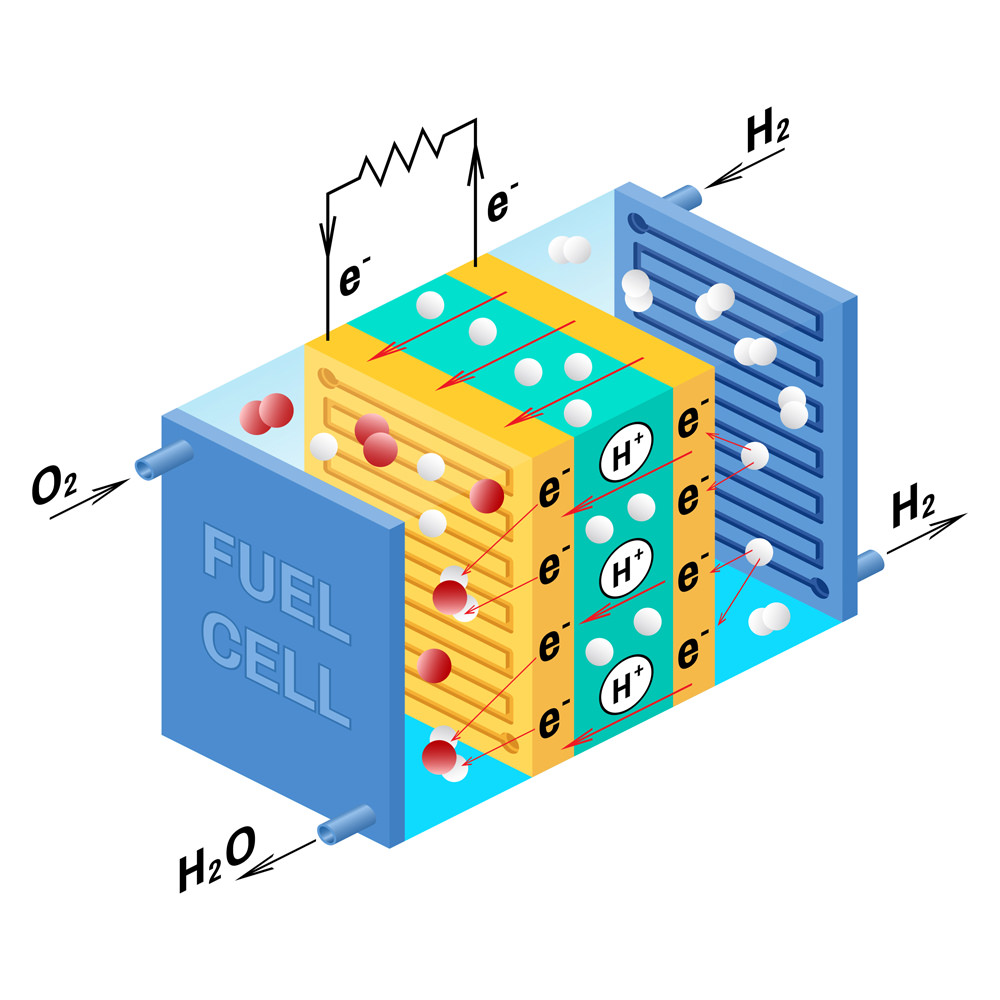
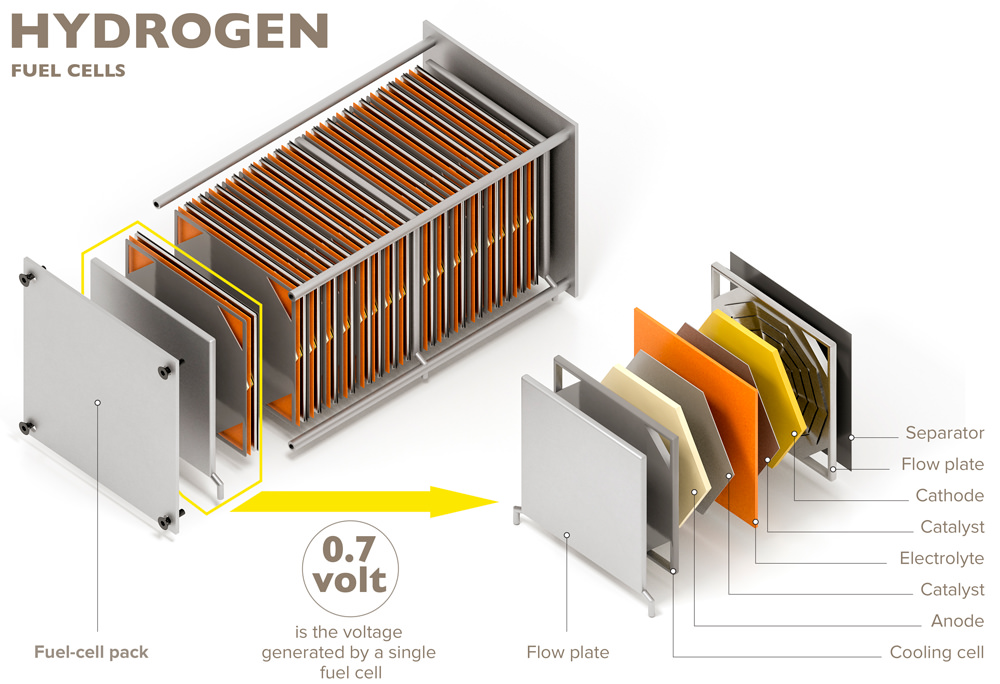
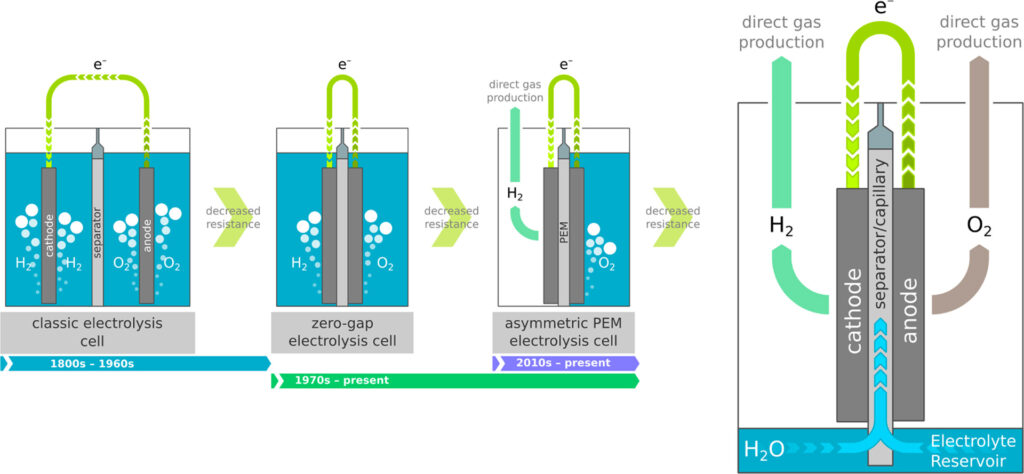
Una cella a combustibile è un dispositivo elettrochimico di generazione di energia che combina il l’idrogeno con l’ossigeno dell’aria per produrre elettricità, con acqua e calore come unici sottoprodotti. Sistemi di celle a combustibile che siano sicuri, funzionali ed efficienti e la relativa infrastruttura di supporto –elettrolizzatori e stazioni di rifornimento di idrogeno (HRS) – svolgeranno un ruolo fondamentale nella transizione all’energia sostenibile. L’ambito di applicazione dei sistemi di celle a combustibile odierni si estende dalle applicazioni portatili su piccola scala nella gamma dei Watt alle installazioni sul campo di grandi dimensioni con la fornitura di energia nella scala dei Megawatt.